Naslov sestavka naj vas ne zavede, saj ne bomo obujali spominov na nadaljevanko »Buffy, izganjalka vampirjev«. Govorili bomo o krvnem dopingu, kot pogosto imenujemo zviševanje števila rdečih krvničk v krvi (eritrocitov, angl. okrajšava RBC: Red Blood Cells) ob pomoči različnih nedovoljenih sredstev. Športniki si želijo povečati število eritrocitov v krvi, ker večje število rdečih krvničk lahko do mišic prinese več kisika, to pa izboljša vzdržljivost in zmogljivost ali drugače, kasneje se zadihajo, kasneje dobijo »musklfiber«. Vendar pa se zaradi večjega števila rdečih krvničk kri zgosti, kar prekomerno obremeni srce, nastanejo tudi krvni strdki, celotna zgodba pa se lahko v skrajnem primeru konča s smrtjo zaradi kapi ali infarkta.
Kar nekaj vrhunskih atletov, ki so umrli zaradi infarkta, najpogosteje v spanju saj je takrat srčni utrip najnižji, je imelo v krvi nenormalno povišano koncentracijo rdečih krvničk. A to še ni vse. Naše telo rekombinantni humani eritropoietin (rHuEPO), eno izmed nedovoljenih sredstev, ki se zlorablja za povišanje števila eritrocitov, prepozna kot tujo snov in proti njej proizvaja protitelesa, ki pa nato izničijo tudi delovanje tistega EPA, ki ga proizvaja naše telo samo, kar vodi v slabokrvnost. Seveda pa se število rdečih krvničk v krvi kot fiziološki odgovor telesa na pomanjkanje kisika lahko poviša tudi, kadar bivamo na višjih nadmorskih višinah, a v tem primeru še ne govorimo o dopingu.
Transfuzija rdečih krvničk
Najbolj preprost in do pojava rHuEPA tudi daleč najbolj uporabljan način krvnega doping je transfuzija rdečih krvničk. Rdeče krvničke lahko iz krvi z lahkoto skoncentriramo ter do 6 tednov hranimo pri 2-6°C ne da bi pri tem odmrle ali izgubile svojo aktivnost. Do dodatnih eritrocitov se lahko dokopljemo s homologno ali avtologno transfuzijo. Pri prvi je darovalec eritrocitov nekdo drug, pri slednji pa mi sami. Če se odločimo, da bomo lastno kri shranili »na zalogo«, moramo računati s tem, da bomo nekaj časa po odvzemu slabokrvni, kar za vrhunskega športnika, ki mora redno trenirati, ni najbolj ugodno. A prednosti avtologne pred homologno transfuzijo niso nepomembne, saj možnosti okužbe s katero od bolezni, ki se prenašajo s krvjo, praktično ni. In kar je v času številnih dopinških kontrol tudi zelo pomembno, sodobni izganjalci hudiča, biokemiki v belih haljah, zaenkrat še ne znajo odkriti in dokazati, ali si je nekdo z uporabo avtologne transfuzije umetno zvišal število rdečih krvničk. A morda ta dan ni več daleč. Način testa je zaenkrat, da bi si ljudje, ki se ukvarjajo s kontrolo dopinga, pridobili vsaj nekaj prednosti, strogo varovana skrivnost. Na spletnih straneh lahko sicer najdemo informacije, da prav veliko možnosti razvijalci testa nimajo, vse skupaj pa je pospremljeno tudi s špekulacijami o delovanju samega testa.
Za razliko od avtologne pa zlorabe homologne transfuzije ni tako težko odkriti. Na površini rdečih krvničk imamo namreč celo množico proteinov (antigenov), od katerih so najbolj znani antigeni skupine AB0 in Rh faktor, saj je ob dajanju transfuzije v izogib nezaželenim imunskim reakcijam potrebno zagotoviti ujemanje oz. kompatibilnost omenjenih antigenov. Poleg antigenov skupine AB0 in Rh faktorja se na površini rdečih krvničk nahajajo tudi številni drugi proteini/antigeni, pri katerih ni tako pomembno, da sta krvodajalec in prejemnik medsebojno kompatibilna, vsaj dokler prejemnik transfuzij ne prejema preveč pogosto.
Vsega skupaj poznamo kar 29 različnih sistemov krvnih skupin, npr. MNS sistem, Lewisov sistem… S testi za odkrivanje homologne transfuzije pregledujejo nekatere izmed teh preostalih antigenov. Antigene na površini rdečih krvničk označimo z različnimi za posamezen antigen specifičnimi fluorescentnimi barvili, označene rdeče krvničke nato spustimo skozi napravo imenovano pretočni citometer. V napravi je laser, ki povzroči, da naše krvničke »svetijo«, seveda vsaka sveti drugače, odvisno od tega, s katerim barvilom je bila »pobarvana«. Različno obarvane celice v pretočnem citometru prepozna in loči »sorter«, na papirju ali zaslonu pa se nam nato izriše vzorec značilen za set antigenov, lasten preiskovani osebi. Če je oseba prejela homologno transfuzijo, se dodatno izriše še drug, običajno slabše zastopan vzorec značilen za set antigenov, ki je lasten krvodajalcu, od katerega je preiskovana oseba prejela transfuzijo.
Samo v treh primerih je možno, da ima nekdo dva seta antigenov in pri tem ni prejel homologne transfuzije:
- Preiskovani osebi so pred kratkim presadili kostni mozeg.
- Preiskovana oseba ima dvojajčnega dvojčka. Včasih se namreč zgodi, da si dvojčki v maternici izmenjajo celice.
- Zgodaj v razvoju v maternici je prišlo do zlitja dveh embrijev, človek je tako imenovana himera in v sebi nosi celice obeh zarodkov.
Z zgoraj opisano metodo so na letošnjem Touru Alexandru Vinokourovu dokazali, da si je pomagal s homologno transfuzijo, pozitivna sta bila tako vzorec A kot vzorec B. Vinokourovu grozi dvoletna prepoved tekmovanja in plačilo globe v višini enoletne plače. Poleg tega so ga v klubu Astana, za katerega je tekmoval, že odpustili. Pred njim je podobna usoda doletela tudi Tylerja Hamiltona in Ivana Basso. Slednji je bil vpleten v znamenit antidopinški primer, imenovan “Operacion Puerto”, v katerem je bil španski zdravnik Eufemanio Fuentes leta 2006 obtožen, da je z nedovoljenimi sredstvi do boljših rezultatov pomagal skoraj 200 atletom. Poleg Bassa je na seznamu imen tudi Jan Ullrich. Naj omenim, da se je prej omenjeni Tyler Hamilton sprva na sodišču skušal oprati, češ da je on sam himera in so zato pri njem zasledili dva seta antigenov. Kasneje je svojo trditev, očitno osnovano na trhlih tleh, umaknil.
Kako dokažemo jemanje EPA?
Eritropoietin, na kratko EPO, je hormon, zgrajen iz sladkorne in beljakovinske komponente (od to ime gliko-protein), ki ga proizvajajo celice ledvične skorje, ki so še posebej občutljive na pomanjkanje kisika. Ko se jim po domače povedano zazdi, da »dihajo slab zrak«, povečajo izločanje EPA, ki nato v kostnem mozgu spodbuja razvoj rdečih krvničk, spodbuja pa tudi proizvodnjo hemoglobina, beljakovine, ki varno spravljena v rdečih krvničkah, porabnikom po telesu dostavlja kisik. Poleg ledvic nekaj malega EPA nastane tudi v jetrih. EPA za razliko od inzulina in nekaterih drugih proteinov do pojava rekombinantne različice ni bilo moč pridobiti v zadostnih količinah niti za zdravljenje slabokrvnosti, kaj šele da bi kdo pomislil na doping. Ameriško podjetje Amgen je pod blagovno znamko Epogen kot prvo leta 1989 lansiralo rekombinantni humani EPO (rHuEPO).
Svetovna antidopinška agencija – WADA (World Anti Doping Agency) je EPO uvrstila na seznam prepovedanih substanc že v začetku 90-ih. A raj zlorab je trajal vse tja do leta 2000, ko so na olimpijskim igrah v Sydneyu pričeli s sistematičnim testiranjem rHuEPA v urinu udeležencev. Zloraba rHuEPA se je od uvedbe testa zmanjševala, ponovno pa se je povečala zloraba transfuzije. Toda, ali za rHuEPO ne obstajata tudi krvni test? In kateri od obeh je merodajen? Krvni, urinski ali oba? Menda test ni zanesljiv? Kdo ga lahko izvaja? In kaj sploh pomenita rezultata vzorca A in vzorca B?
Res obstaja tudi krvni test, ki pa v krvi ne zazna rHuEPA, ampak na podlagi nenormalnih vrednosti določenih krvnih parametrov, med drugim tudi hematokrita, nakaže možnost krvnega dopinga, pri čemer bi šlo lahko tako za transfuzijo kot za zlorabo EPA, uporabo kake druge nedovoljene substance, lahko pa je športnik zgolj neke vrste genetski fenomen oziroma je živel in treniral na velikih višinah. Skratka, nič dokončnega. Krvni test je torej neke vrste presejalni test, ki pa ne da dokončnega odgovora in od leta 2003 po merilih WADA ni več nujen predpogoj za to, da športniku dokažejo zlorabo rHuEPA. Zakaj ga pa potem sploh izvajajo? Kot vedno so v pomanjkanju bolj tehtnih razlogov poglavitni razlog stroški. Krvni test je namreč od urinskega testa bistveno cenejši, saj stane le 60 $. Na podlagi rezultatov krvnega testa se tako odločijo, koga bi bilo smiselno poslati še na 400 $ drag urinski test.
Eden izmed parametrov, ki ga pri krvnem testu gledamo, je hematokrit (HCT). Ta nam pove, kolikšen volumski delež celotne krvi zavzemajo rdeče krvničke. Izražamo ga v odstotkih, npr. hematokrit 38% pomeni, da v 100 mL krvi eritrociti zavzemajo volumen 38 mL. Normalne vrednosti hematokrita za moške se gibljejo med 41-50%, za ženske med 36-44%. Povišane vrednosti hematokrita so lahko znak številnih bolezni, npr. policitemije, pri kateri kostni mozeg proizvaja preveliko število eritrocitov, po drugi strani pa lahko nakazujejo tudi na krvni doping. Ker samo hematokrit ni dovolj zanesljiv pokazatelj, se poleg tega gleda tudi koncentracijo hemoglobina. Običajne vrednosti za moške so 140-170 g/L, za ženske 120-150 g/L. Mednarodna kolesarska zveza (UCI – Union Cycliste International) tako za 15 dni suspendira vsakega moškega atleta, pri katerem so vrednosti HCT nad 50% in vrednosti hemoglobina nad 170 g/L.
Urin razkriva zlorabo EPA
Za razliko od krvnih testov lahko z urinskim testom neposredno zaznamo EPO v urinu preiskovane osebe. Test deluje na osnovi metode izoelektričnega fokusiranja (IEF) in detekcije s protitelesi, specifičnimi za EPO.
Izoelektrično fokusiranje je ena izmed osnovnih tehnik v analitiki proteinov. Vsak protein je pri določeni pH vrednosti, imenovani izoelektrična točka, na zunaj navidezno električno nevtralen, število pozitivnih nabojev je enako številu negativnih nabojev. Predstavljajmo si, da vzorec nekega proteina nanesemo v gel, v katerem smo poprej vzpostavili pH gradient in gel priklopimo v električno polje. Naš protein, ki je npr. pri pH vrednosti, pri kateri smo ga na gel nanesli, negativno nabit, bo potoval proti pozitivno nabiti anodi. Gibal se bo vse dokler ne bo dosegel pH vrednosti v gelu, ki je enaka njegovi izoelektrični točki. Takrat bo na zunaj električno nevtralen in gibanje se bo ustavilo. Če imamo v vzorčku dva proteina z različnima izoelektričnima točkama, ju lahko z metodo IEF med seboj ločimo. Proteini so pri pH vrednostih pod izoelektrično točko pozitivno, pri pH vrednostih nad izoelektrično točko pa negativno nabiti.
EPO je mešanica več različic glikoproteina – govorimo o glikoformah, pri katerih je beljakovinska komponenta v glavnem enaka pri vseh glikoformah, posamezne glikoforme pa se razlikujejo v sladkorni komponenti, kjer je za razumevanje principa izoelektričnega fokusiranja bistvenega pomena le en sam gradnik, tj. sladkor sialična kislina. Sialične kisline so v svetu sladkorjev nekaj posebnega zato, ker so za razliko od večine ostalih sladkornih gradnikov negativno nabite. Če nekoliko poenostavimo, lahko rečemo, da se posamezne glikoforme EPA razlikujejo v številu sialičnih kislin, pripetih na sladkorno komponento. Za EPO se številka lahko giblje med 0 in 14 sialičnimi kislinami na glikoformo EPA. Teoretično bi lahko vzorec EPA po IEF vseboval do 14 različnih proteinskih lis – glikoform. Vzorcu lis, ki so značilne za določeno obliko EPA, pravimo tudi IEF-profil.
Znano je, da je telesu lasten EPO kot pravimo v žargonu bolj »kisel« v primerjavi z rHuEPOm, kar pomeni, da povprečna molekula telesu lastnega EPA vsebuje več sialičnih kislin kot povprečna molekula rHuEPA. In prav v tem je lepota urinskega testa, ki deluje na principu metode IEF. Zaradi omenjene razlike je test zmožen ločiti med telesu lastnim EPOm in rHuEPOm in to kljub temu, da sta v urinu IEF-profila obeh oblik naložena ena na drugo.
Še več, test je zmožen zaznati tudi genetsko modificirano različico EPA, imenovano darbepoetin alfa, ki jo podjetje Amgen trži pod imenom Aranesp in ki so ji raziskovalci v omenjenem podjetju dodali še dva sladkorja. EPO in rHuEPO imata tako 4 vezavna mesta, na katera se lahko pripnejo sladkorne komponente, darbepoetin alfa pa kar 6. In več sladkornih komponent pomeni tudi več sialičnih kislin, darbepoetin je tako celo bolj »kisel« kot telesu lasten EPO, saj ima lahko teoretično na molekulo glikoproteina vezanih do 22 sialičnih kislin.
Izboljšani EPO?
Preden si razlike med EPOm, rHuEPOm in darbepoetinom alfa ogledamo na praktičnem primeru in se tako na lastne oči prepričamo, da prej opisan test res deluje, naj razložim, zakaj so se v podjetju Amgen odločili izdelati genetsko spremenjeno različico EPA. Mar narava ni izdelala najboljšega možnega EPA?
Sladkorni deli EPA so zelo pomembni za njegovo aktivnost zato, ker vplivajo na čas, ki ga molekula prebije v krvotoku. Večina EPA se iz telesa odstrani preko ledvic, nekaj malega pa tudi preko jeter. Sladkorji, vezani na EPO, močno povečajo velikost same molekule. Sladkorni del namreč obdaja veliko vode, tako imenovan hidratracijski ovoj. Kot vemo, ledvice delujejo kot filtratorji, večja, kot je molekula, težje se preko ledvic odstrani iz telesa. S samo filtracijo se iz telesa odstrani le manjša količina nerazgrajenega EPA, večina molekul se pred tem razgradi. Mehanizem same razgradnje še ni natančno pojasnjen, znano pa je, da se morajo molekule EPA najprej vezati na EPO-receptor in preko njega vstopiti v celico. Vse kaže, da se EPO kot večina proteinov razgradi v »celičnem smetišču«, tj. v lizosomih. Tudi pri sami vezavi na EPO-receptor ima sladkorna komponenta pomembno vlogo. Ker je zelo velika, ovira vezavo EPA na receptor. Več kot ima molekula EPA vezanih sladkorjev, slabše se torej veže na receptor, zato se tudi počasneje odstrani iz krvotoka in razgradi.
S tem, ko so v podjetju Amgen EPU dodali dva dodatna sladkorja, se je njegova življenjska doba v telesu zelo podaljšala, posledično pa tudi biološka aktivnost. Aranesp (darbepoetin alfa) je tako za enak učinek potrebno injicirati precej manj pogosto kot Epogen (rHuEPO). To seveda ne pomeni, da narava ni ustvarila najboljšega EPA. Telesu lasten EPO je namenjen uravnavanju nastanka in števila eritrocitov pri sicer zdravem človeku, medtem ko je Aranesp zdravilo za zdravljenje slabokrvnosti, ki se razvije kot posledica različnih obolenj (npr. bolezni ledvic) ali kot posledica terapij, ki jih sodobna medicina uporablja za zdravljenje določenih bolezni, npr. po kemoterapiji.
Primer urinske analize EPA
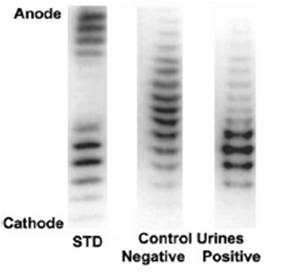
Na sliki 1 v prvi stezi opazimo 2 ločeni skupini lis (2 IEF-profila) – glikoform. Spodnja, tista bliže negativno nabiti katodi (območje bolj bazičnih pH vrednosti), ponazarja tipičen vzorec Epogena (rHuEPO), zgornja skupina lis, ki je bliže pozitivno nabiti anodi (območje bolj kislih pH vrednosti) pa vzorec Aranespa (darbepoetin alfa). Vzorec telesu lastnega EPA je prikazan v drugi stezi, vidimo, da je glavnina glikoform v vmesnem pH območju, torej nekje med obema rekombinantnima različicama EPA. V tretji stezi je vzorec urina, v katerem vidimo, da sta profil telesu lastnega EPA in profil rHuEPA naložena drug na drugega. Vzorec zagotovo prihaja od osebe, ki je nedavno prejela rHuEPO.
Po primer športnika, ki je bil pozitiven na urinskem testu, nam ponovno ni treba daleč v preteklost. Letošnji Tour je bil očitno praktikum vseh možnih zlorab. Tako se je sum na morebitno zlorabo EPA pojavil pri odličnem baskovskem kolesarju Ibanu Mayu. Pozitiven je bil namreč njegov vzorec A. Kljub več kot polurnemu brskanju po internetu se mi do podatka, kaj je pokazal rezultat vzorca B, ni uspelo dokopati. Sem pa na strani Iban Mayo Blog (http://ibanmayoblog.blogspot.com/) naletela na zanimivo anketo z vprašanjem – kaj se je zgodilo z vzorcem B? Možni odgovori: »Vzorec B so ukradli«, »Rezultat je negativen«, »Rezultat je pozitiven«, »Laboratorij, ki naj bi testiral vzorec B, ne obstaja«, »Vzorec B so zamešali«. Zmagovalec je z 31% sicer odgovor, da je bil rezultat vzorca B negativen, a odgovor, da so vzorec zamešali, s 26% ni prav daleč zadaj. Dejstvo, da Iban Mayo trenutno še vedno ne tekmuje, pa ostaja.1
Kako veliko pa je časovno okno, v okviru katerega je test v urinu še sposoben zaznati katero od rekombinantnih različic EPA? Še leta 2003 je bilo to okno zelo ozko, pri večini je test zlorabo zaznal le, če od injiciranja EPA ni minilo več kot 48 ur. Menda pa so sedaj test že tako izboljšali, da zazna tudi EPO, ki je bil injiciran nekaj tednov pred testiranjem.
Se test lahko zmoti?
Najbolj pogosta očitka testu sta, da ni dovolj specifičen, da torej ni zagotovo, da lise, ki jih vidimo, dejansko predstavljajo EPO in ne kak drug protein iz urina oziroma, da lahko ob nepravilnem hranjenju ali pripravi vzorca pride do določenih sprememb, katerih posledica je lažno pozitiven rezultat. Najprej si poglejmo, kako je zagotovljeno, da test resnično »vidi« le EPO.

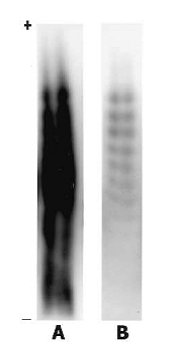
Omenjeno težavo so v testu rešili tako, da naredijo še en prenos proteinov na novo membrano, pri čemer se tokrat prenesejo le primarna anti-EPO protitelesa. In kako to dosežejo? Prenos na novo membrano poteka pri kislih pH vrednostih, pri katerih prej omenjeni kompleksi EPA in primarnih protiteles razpadejo, po drugi strani pa kisel pH ne poruši vezave proteinov (tako EPA kot tudi ostalih urinarnih proteinov) na membrano, saj so le-ti nanjo vezani s hidrofobnimi vezmi, na katere pa pH ne vpliva. Tako ostanejo EPO in urinarni proteini vezani na prvo membrano medtem ko se primarna protitelesa nemoteno prenesejo na novo membrano. Izboljšava, ki jo dosežemo z »double-blottingom«2 je očitna (steza B na sliki 3).
Nova orožja sodobnih izganjalcev hudiča
Že prej sem omenila, da je metoda IEF, s katero ugotavljamo morebitno zlorabo EPA, osnovna, pravimo tudi bazična, tehnika v analitiki proteinov. Obstaja cela vrsta dosti bolj »sofisticiranih« metod, ki so bolj točne in ponovljive ter o molekuli EPA nudijo več informacij. A bistvena pomanjkljivost vseh je, da bodisi niso dovolj specifične oz. selektivne (niso zmožne razločiti EPA izmed množice proteinov v urinu) ali pa niso dovolj občutljive (za analizo potrebujejo bistveno več materiala – EPA). Kljub temu raziskovalci pridno delajo na razvoju boljšega, izpopolnjenega testa, zato si poglejmo, v katero smer gredo njihove raziskave in kaj vse jim je že uspelo.
Priprava vzorca urina za analizo z metodo IEF je zelo neselektivna. S posebnimi napravicami – koncentratorji skoncentriramo vse molekule v urinu, ki so večje od določene molekulske mase, v našem primeru 30 kDa. Vse molekule manjše od 30 kDa iz urina sicer odstranimo, a ni prav veliko proteinov, katerih molekulska masa bi bila manjša od 30 kDa. Končni vzorec, ki ga nanesemo v gel, je tako mešanico velikega števila različnih proteinov, zato so se morali razvijalci testa zateči k prej opisanemu »double-blottingu« in tako testu zagotoviti potrebno specifičnost.
Sedaj je na voljo tudi nov, bolj selektiven način priprave vzorca za analizo IEF, ki izkorišča princip imuno-afinitetne kromatografije. Vzorec urina spustimo preko kolonice, ki ima vezana anti-EPO protitelesa. EPO se »ujame« na kolonico, ostali proteini iz urina pa »padejo skozi«. V naslednjem koraku spremenimo pH pufra, s katerim spiramo kolonico, kompleksi EPA in anti-EPO protiteles razpadejo in EPO se spere s kolonice. Gre za enak princip, kot ga uporablja prej opisani urinski test za selektiven prenos primarnih anti-EPO protiteles na novo membrano. Na ta način dobimo že zelo prečiščen vzorček, ki vsebuje praktično le EPO. Ker je vzorec že dovolj prečiščen za detekcijo ne potrebujemo več »double-blottinga«, EPO lahko detektiramo z običajnim »blottingom«. Ne vem, v kolikšni meri se omenjena priprava vzorca že uporablja v rutinske namene. Največji izziv namreč predstavlja prav priprava dovolj velike količine ustreznih anti-EPO protiteles. Protitelesa lahko zaenkrat pripravimo le tako, da človeški EPO vbrizgamo v žival (zajec, koza, ovca) in po določenem času anit-EPO protitelesa izoliramo iz seruma imunizirane živali.
Trenutno precej obeta tudi metoda MAIIA (Membrane Assisted Isoform Immunoassay). Kako deluje?
- Vzorec urina prečistimo preko imuno-afinitetnih kolonic, kot je opisano zgoraj.
- V drugem koraku na posebnih čipih z metodo anionske kromatografije (AEX) ločimo različno nabite oblike EPA med seboj. Kot pri metodi IEF so tudi pri metodi AEX za ločbo različnih oblik EPA ključnega pomena negativno nabite sialične kisline. Pri anionski kromatografiji se na kolonico/čip vežejo negativno nabite oblike EPA. Bolj kot so nabite (kar v prevodu pomeni več sialičnih kislin na molekulo EPA), težje jih speremo s kolonice/čipa. S spreminjanjem lastnosti pufra, s katerim spiramo kolonice/čipe, lahko podobno kot prej pri metodi IEF med seboj ločimo različne glikoforme EPA.
- Sledi »on-line« detekcija, ki je ravno tako kot pri metodi IEF osnovana na uporabi protiteles (imuno-detekcija) in kot taka zelo občutljiva.
Prvi rezultati z omenjeno metodo so zelo obetajoči, v primerjavi z metodo IEF naj bi MAIIA še dosti bolje razlikovala med rekombinantnimi oblikami in »naravnim« EPOm. Metoda MAIIA je bistveno hitrejša, rezultat je na voljo v par urah, je tudi občutno cenejša, bolj avtomatizirana, za korektno izvedbo testa je potrebnih precej manj izkušenj.
In dobesedno za posladek, s to metodo bi lahko odkrili tudi nove sladkorne različice EPA, saj lahko na čipe vežemo tudi lektine, beljakovine, ki prepoznajo in med seboj ločijo različice na EPO vezanih sladkornih komponent.
Viri
- Lasne et al. Analytical Biochem 311 (2002) 119-126.
- Lasne et al. J Immunol Methods 253 (2001) 125-131.
- Magnani et al. Blood, cells, molecules and disease 27 (2001) 559-571.
- Catlin et al. Blood 109 (2006) 1778.
- Gross and Lodish JBC 281 (2006) 2024-2032.
- http://www.wada-ama.org/en/
- http://www.cyclingnews.com/
- http://www.letsrun.com/
- http://www.velonews.com/news/fea/12924.0.html
- http://en.wikipedia.org/wiki/Blood_doping
- http://www.newscientist.com/article/dn6456.html
- Morda je kateri izmed bralcev opazil, da je proteinskih lis v vzorcu telesu lastnega EPA, ki je prikazan na sliki 1, več kot prej omenjenih 14. Od kod torej te dodatne lise? Prej vam s tem nisem želela mešati glave, saj za samo razumevanje urinskega testa ni bistvenega pomeni, a tudi na proteinskem delu EPA, za katerega sem prej dejala, da je v glavnem pri vseh glikoformah enak, lahko prihaja do določenih sprememb, katerih posledica je pojav dodatnih proteinskih lis. Skupno vsem tem spremembam je, da molekula EPA bodisi izgubi bodisi pridobi dodaten naboj. Poleg tega sialične kisline niso edini nabiti gradniki sladkornega dela molekule. Negativen naboj lahko prispevajo tudi sladkorji, ki imajo vezano fosfatno ali sulfatno skupino. In prav slednji naj bi bili v »naravnem« EPU bolj zastopani kot v rekombinantni različici. ↩
- Zakaj je urinski test tako zelo občutljiv? Kot rečeno, dodamo po prenosu na novo membrano sekundarna protitelesa, ki se vežejo na primarna protitelesa. A to niso navadna protitelesa. Vezane imajo molekule biotina. V naslednjem koraku dodamo konjugat encima hrenove peroksidaze in beljakovine streptavidin. Ena molekula streptavidina lahko veže do 4 molekule biotina. Z uporabo kombinacije biotin – streptavidin ojačamo signal in tako povečamo občutljivost testa. A biotin-streptavidin ni edini trik, ki so ga razvijalci testa uporabili za povečanje njegove občutljivosti. V zadnjem koraku membrani dodamo substrat za encim hrenovo peroksidazo. In, kot ste morda uganili, ponovno ne gre za kar navaden substrat. Naš substrat omogoča kemiluminiscenčno reakcijo, lise EPA tako zaznamo na fotografskem filmu. No, če smo natančni, v bistvu EPA ne zaznamo neposredno, saj je le ta ostal vezan na prvi membrani, preko kaskade protiteles-biotin-streptavidin in encima zaznamo primarna protitelesa, ki so se na prvi membrani vezala na EPO. Kemiluminiscenčni način detekcije je precej bolj občutljiv kot običajna kolorimetrična detekcija, tj. detekcija na podlagi barvne reakcije, pri kateri pretvori hrenova peroksidaza substrat v modro-vijolično obarvan produkt na membrani. ↩